
История
Часть товаров из корзины будет перемещена в статус отложенных и не сможет быть оформлена для заказа, если вы продолжите работу в данном регионе
История

История
История

Содержание статьи:
Развитие науки можно сравнить со сбором грибов. Долгое время грибник может ходить по лесу с очень скудной добычей. Но стоит набрести на “грибное место”, и адепту тихой охоты обеспечены полные корзины трофеев, вызывающих зависть у друзей и попутчиков. Более того, теперь грибник ещё не раз вернётся на заветную полянку, находя там всё новый и новый урожай.
В науке такими грибными местами становятся либо новые методы интерпретации данных, так пифагорейцы достигли немалых успехов в математике, но не имея доступа к позиционной системе счисления, вынуждены были довольствоваться геометрическими и музыкальными выражениями своих теорий, либо новые методы получения данных. О них и пойдёт речь далее.
Каждый раз, появление нового метода сродни появлению у учёных нового органа чувств. В биологии последним на данный момент случаем такого усовершенствования исследователей стало появление метода секвенирования. Благодаря ему теперь мы знаем какова на самом деле структура биомолекул.
Впрочем, для современных биологов это уже не роскошь, а само собой разумеющееся положение вещей. Но грибное место продолжает радовать исследователей всё новыми и новыми вариантами этой, без преувеличения, ключевой для современной науки технологии. О трёх из них мы сегодня и поговорим. (Рекомендуем статью: "Современный подход к культивированию микроорганизмов и культур клеток")
 Транскриптомное профилирование
Транскриптомное профилирование
Основной постулат молекулярной биологии гласит, что информация, записанная в генетическом коде клетки, реализуется в виде синтеза белка, при посредстве РНК. То есть сначала в процессе транскрипции, появляется копирующая ген РНК. И уже на РНК в процессе трансляции, синтезируется белок.
При этом, белки чрезвычайно разнообразны, и выделение их из клетки может вызвать методические трудности. А вот РНК, пусть даже их три вида, транспортная, информационная и рибосомальная, достаточно однородна по своим свойствам. Так что выделение содержащейся в клетке РНК, хотя и имеет определённые сложности, уже стало отработанным, рутинным процессом.
Вся находящаяся в клетке РНК называется транскриптомом, и по нему можно судить, чем именно клетка занята. Причём оценка эта строго количественная. Транспортная или рибосомальная РНК напрямую показывают, насколько активны процессы синтеза белка. В то же время определение матричных РНК даёт гораздо более дифференцированное представление о том, какие именно белки синтезируются в этой части организма. Инновационное оборудование позволяет оценивать эти процессы даже в единичных клетках.
Процесс скорее длительный, чем сложный. Правда, необходимо уже иметь аннотированный референсный геном исследуемого организма. Ну а дальше дело техники. Причём в прямом смысле слова: большинство процедур выполняют специальные программы. Результатом их работы становится количество ридов РНК,
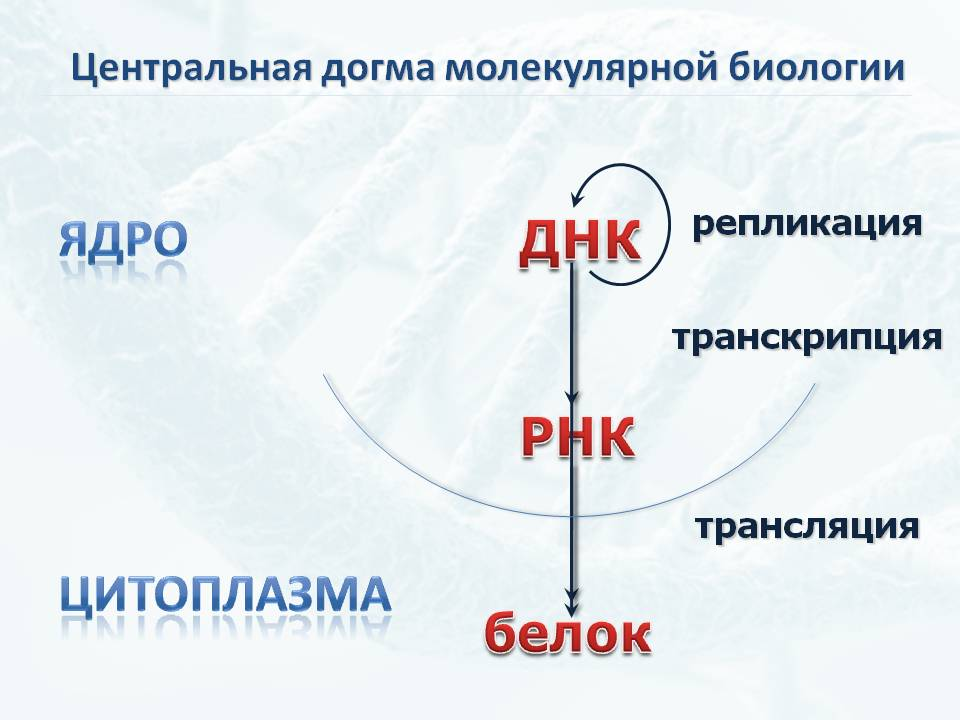
соответствующих разным участкам ДНК. Простыми словами, это показывает, какие именно гены активны и участвуют в синтезе белка в данный момент. Ну а уже по тому, что это за белки, какова их функция, можно сделать вывод, какие функции выполняет клетка в целом.
Помимо научных проблем, этот метод позволяет решать и сугубо практические задачи. Определение функциональности ткани или органа с профилированием транскриптома становится не просто вопросом клинических наблюдений, но вполне объективным показателем. Существует широкий спектр оборудования, позволяющего решать данные задачи.
Впрочем, есть у профилирования транскриптома и ещё более тонкие вариации, позволяющие решать ещё более специфические задачи. Например, не просто выявление активно транскрибируемых генов, но и более продуктивных аллелей, или выявление альтернативного сплайсинга. Последнее стало особенно актуально при исследовании кальмаров, когда выяснилось, что, в отличие от многих других организмов, у них нет однозначного соответствия “один ген ‒ один белок”. Наоборот, использование разных вариантов сплайсинга ‒ вырезания из РНК некодирующих участков, позволяет небольшому количеству пересекающихся участков генома кодировать значительное число белков.
Помните, выше говорилось, что для успешного транскриптомного профилирования нужен аннотированный референсный генотип? Вот, его получение для самых разных организмов ‒ сейчас одна из наиболее актуальных задач молекулярной биологии.
Однако если бы единственным способом определения последовательности ДНК до сих пор было наиболее распространённое в лабораториях секвенирование по Сэнгеру, геном даже простейшего организма пришлось бы расшифровывать годами. Собственно, на прочтение человеческого генома ушло 13 лет. И это при том, что на протяжении проекта появлялись всё более совершенные методики и оборудование, а задействованы в данном проекте были сотни лабораторий по всему миру. (Рекомендуем статью: "Инновационные технологии для поиска и разработки новых лекарств")
Впрочем, секвенирование по Сэнгеру не зря остаётся золотым стандартом определения последовательностей хранящих генетическую информацию молекул. Причина тому ‒ его крайне высокая точность и сравнительно несложная автоматизация. Ну а скорость порой можно принести в жертву. Даже в наш стремительный век научные исследования ‒ не самый быстрый процесс.
Впрочем, совершенствование методик и оборудования не стоит на месте. Одним из последних достижений в сфере чтения последовательностей нуклеиновых кислот стало высокопроизводительное секвенирование.
Не вдаваясь в технические подробности, суть метода заключается в том, что геном разделяется на множество фрагментов, каждый из которых попадает в свой микроскопический реактор. Это возможно за счёт создания эмульсии с мельчайшими наноразмерными каплями, в каждой из которых присутствуют необходимые для реакции вещества. И вот, вначале каждый фрагмент ДНК накапливается за счёт полимеразной цепной реакции, а затем иммобилизируется и проходит процесс почти обычного секвенирования.

Разница с традиционным методом заключается в том, что фиксируется присоединение каждого отдельного нуклеотида. Напомним, что в стандартном методе сначала происходит синтез всего участка генома, но после каждого нуклеотида часть продуктов реакции больше не растёт. Таким образом, результатом становится смесь отрезков ДНК всех возможных длин. Их потом разделяют при помощи электрофореза. Здесь же всё происходит наоборот. Каждый раз в реакционную смесь подаётся только один вид нуклеотидов, и, если он оказывается подходящим, чтобы присоединиться к растущей копии ДНК, сопутствующие реагенты вызывают свечение.
То есть в данной методике происходит определение последовательности сразу большого числа участков генома, а выявления последовательности не требует дополнительного этапа индикации.
Чем-то напоминает предыдущую методику и довольно популярная нынче процедура хромосомного микроматричного анализа. Хотя его и нельзя отнести к секвенированию. Помимо последовательности генома, важной характеристикой здоровья человека является отсутствие нарушений в его хромосомах, удвоений или исчезновений отдельных участков.
Суть метода достаточно проста. Основой технологии является использование микроматриц. Это специальные чипы с фиксированными на них маленькими участками ДНК, соответствующими различным областям генетического кода человека. Для анализа используют два вида генетического материала ‒ самого пациента и стандартный шаблон, соответствующий здоровому человеку. Оба материала фрагментируют и метят светящимися маркерами.
В процессе анализа фрагменты изучаемой и стандартной ДНК наносят на микроматрицу. Обе они связываются с фиксированными комплементарными участками, а дальше просто оценивают какой из сигналов, анализируемой или стандартной ДНК, сильнее на каждом участке микроматрицы. При отсутствии аномалий, они не будут отличаться. Если же в генетическом материале будет нехватка, или наоборот избыток, какой-либо части хромосомы, то на этом участке микроматрицы сигнал анализируемой пробы будет слабее, или, соответственно, сильнее.
Впрочем, это не единственное применение данного метода. Если заменить стандартную ДНК на какую-то другую, например, потенциального родителя пациента, то можно обнаружить не аномалии, а сходства и отличия генома двух человек ‒ то есть подтвердить родство.
И на этом закончим рассмотрение новых методов генетического анализа. Это очень обширная и интересная область человеческого знания, но в такой короткой статье невозможно достаточно глубоко погрузиться во всё многообразие методов и технических находок, применяемых сегодня молекулярными биологами.
С помощью личного кабинета Вы сможете:
Сравнение