
История
Часть товаров из корзины будет перемещена в статус отложенных и не сможет быть оформлена для заказа, если вы продолжите работу в данном регионе
История

История
История
Так что же такое синтетическая биология? Не претендуя на то, чтобы эта точка зрения считалась истиной, В.М. Говорун пояснил, как он это понимает.
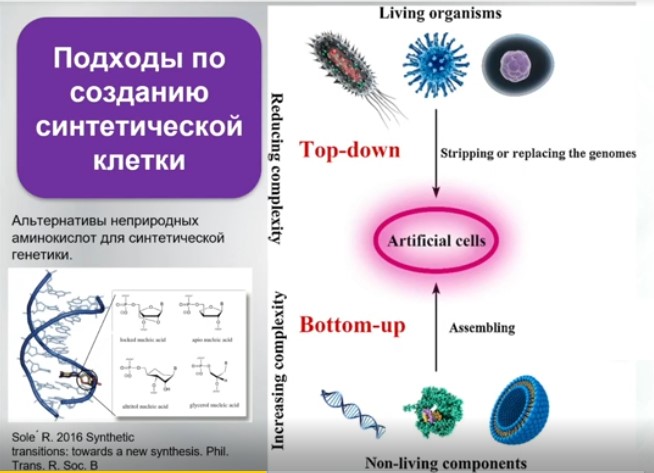
В синтетической биологии цель молекулярного биолога – это каким-то способом (теперь уже с помощью сборщиков, ассемблеров, синтезаторов олигонуклеотоидов – это хорошо отработанный параллельный процесс, локализованный не только на твердофазном объемном синтезе, но и на чипах) создать нечто, что сначала является геном.
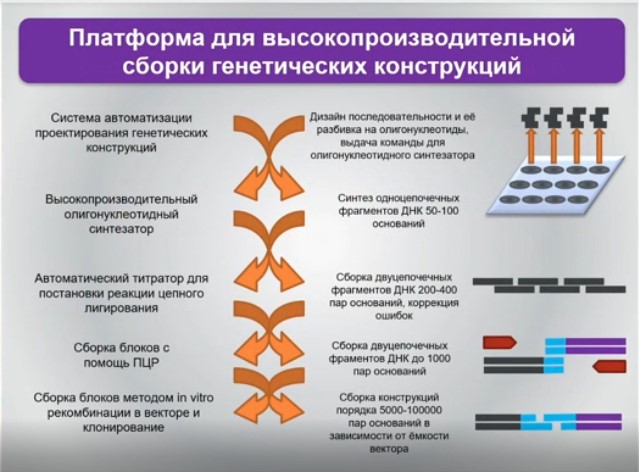
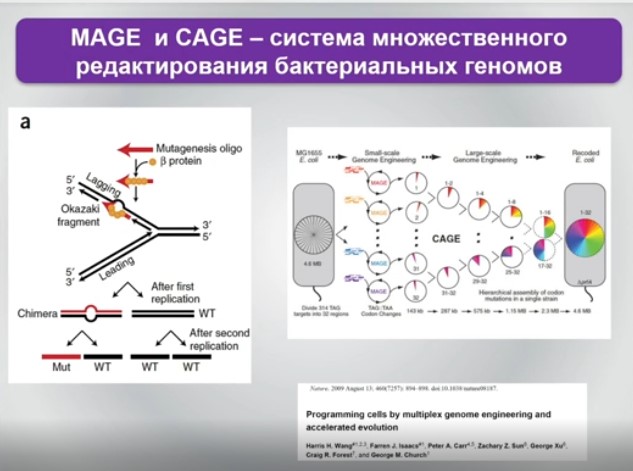
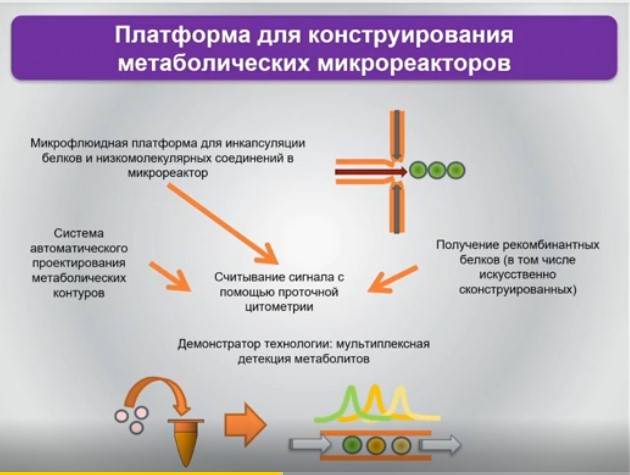
Ближе к практике и второе направление, которое позволяет прийти от «любимого» всеми и традиционно используемого триплета к, например, тетраплету или к созданию дополнительных возможностей для аминоацил-транспортных РНК включать в состав белков так называемые неканонические аминокислоты. Их всего 20 плюс селеноцистеин, но он постсинтетический. Но почему бы не сделать белковую жизнь или белковые свойства более элегантными или вычурными, введя туда нечто принципиально иное, ведь органических аминокислот существенно больше?
Таким образом, сильно изменив свойства этих белков, сделав их термостабильными, или например какими-то гибридными, способными выполнять функции, которые в природе не существуют и не были заложены, человек уже берет на себя некие свойства молекулярного эволюциониста, не наблюдая за природой, а пытаясь активно изменять ее.
Для этого существует большое направление в синтетической биологии, которое идет параллельно с белковой инженерией и пытается, используя живые клетки как реакторы, принципиально их модифицировать в рамках существующего или предсуществующего биологического свойства.
Никто не отменяет E. coli или дрожжи, используемые в таких экспериментах как объект, но ему придают те свойства, которые в природе не подразумевались.
Отсюда появляются тетраплетные коды, дополнительные транспортные РНК, которые могут быть не настолько специфичными и включать аминокислоты, которые содержат, например, фтор или какие-то другие компоненты, сильно влияющие на физико-химические свойства белков, если это нужно для целей биотехнологии.
Задействованы в этих экспериментах и оптические изомеры природных аминокислот. Асимметрия и проблема хиральности актуальна не только для аминокислот, но и для сахаров, и теоретические биологи пытались объяснить, почему так происходит.
Результаты таких экспериментов не всегда ясны, но структуры, полученные заменой L-изомера на D-изомер и другие стереоизомеры, демонстрируются. В ходе этих экспериментов, к сожалению, не удается получить такие же микроорганизмы, которые с точки зрения биологической стоимости, то есть «фитнеса», были бы конкурентоспособны с тем, что существует в природе. Даже если сравнивать не с теми изолятами, которые выделяются из природных источников, а с лабораторными штаммами, которые, как известно, еще в 70 годах специальным образом намного ослаблены. Но даже в этом случае получение молекулярных гибридов – например, включающих другие стереоизомеры аминокислот или сахаров – сталкивается с трудностями: даже при синтезе полисахаридов они обладают низкой выживаемостью. Причина, вероятно, в том, что ученые пытаются отрегулировать процессы согласно генноинженерной концепции. Но не удается заменить все аминокислоты на такие же изомеры: для этого нужны специальные приемы.
Подобные эксперименты скорее можно рассматривать теоретически как попытку оценить упругость антихаоса в клетках. У биологов есть инструменты пертурбации: нагрев, токсины, антибиотики и так далее. При переходе к пертурбационным моделям догенного свойства, которые еще не до конца научились делать, возникает большая проблема: «сколько нужно добавить дозы соответствующего агента?»
Потому что все в этих экспериментах связано с измерением, с учетом количества и типа белков. Представьте, в E. coli 400 белков. Сколько белков может получить изменения и в каких положениях, чтобы клетка потеряла жизнеспособность?
Поэтому биологи к определенным изменениям просто не прибегают, потому что это «не вырастает». А то, что все же «вырастает», пытаются изучать в контексте жизнедеятельности и всего прочего.
Второе направление синтетической биологии – фундаментальное.
Зачастую непонятно, как использовать полученные уже знания для понимания процессов синхронизации, то есть насколько антихаос, который по законам неравновесной термодинамики существует во всех живых системах, является
а) стабильным,
и
б) каковы законы этого антихаоса, которые позволяют самой системе, как например в случае микоплазмы, не меняя или почти не меняя белковый состав, адаптироваться к тем или иным внешним воздействиям, пертурбациям или просто жизни в природе?
Так что синтетическая биология – это очень объемный комплекс новой биологии, как когда-то из классической биологии и биохимии возникла молекулярная биология.
Она позволяет использовать уже наработанные приемы. В этом случае секвенаторы, масс-спектрометры, иные приборы являются некими первичными инструментами – такие «высокотехнологичные гаечные ключи». Как в любой технологии, если она усложняется (а это совершенно точно происходит), требования к качеству и степени проверки каждого шага становятся более жесткими.
Синтез геномов сейчас можно сделать уже просто кастомом, то есть заказывать какие-то фрагменты специализированным компаниям.
Но есть определенные нюансы. Например, одна из концепций гласит, что американским исследователям в 2010 году и впоследствии просто повезло – они выбрали удачную модель и сами признались, что пытались делать разные пары миклоплазмы – получилась только одна.
Первичный проект как был концентрирован на самой простой микоплазме, Mycoplasma Genitalium, которая содержит всего чуть более 570 тысяч нуклеотидов. Это всего лишь в 2 с небольшим раза больше, чем геном большого вируса типа герпесвируса, и примерно в 2,5 раза меньше, чем геном мегавируса.
Раньше у биологов был жесткий критерий раздела между живой или неживой, но ДНК- или РНК- содержащей природой. Они разграничивали вирусы и бактерии, и геномный подход оказался в этом смысле не очень продуктивным, потому что относительно недавно были открыты мегавирусы, геномы которых больше, чем геномы минимальных бактериальных клеток, способных расти на искусственных питательных средах. Но такие вирусы, естественно, автономно (без клетки, в которую можно внедриться) не реплицируются.
Поэтому требуется большая осторожность с формальными определениями.
С помощью личного кабинета Вы сможете:
Сравнение