
История
Часть товаров из корзины будет перемещена в статус отложенных и не сможет быть оформлена для заказа, если вы продолжите работу в данном регионе
История

История
История
Содержание статьи:
Откуда берутся лекарства? У кого-то из аптеки, у кого-то из тумбочки. А вот учёные, занятые в фармацевтической промышленности получают новые лекарства в результате процесса под названием “драг дизайн”.
На протяжении всей истории цивилизации, люди искали способы поправить пошатнувшееся здоровье, приняв внутрь какое-нибудь вещество. Единичные случайные удачи складывались в накопленный опыт. Со временем лекарства применялись всё менее случайно, но вот появление новых полезных веществ всё ещё было делом случая. Порой что-то подобное происходит и сейчас. Примером тому может послужить современная пандемия коронавируса. (Рекомендуем статью: "Генетический анализ в онкодиагностике")
Дело в том, что один из самых долгих и трудоёмких этапов в разработке нового лекарства ‒ это клинические испытания, и особенно их третья стадия. Она нужна для выяснения долговременных последствий его действия. Сейчас, когда условия требуют найти лекарственные средства в сжатые сроки, одно из направлений поиска состоит в том, чтобы найти эффективное против возбудителя вещество среди уже давно применяемых препаратов. Тех, о которых мы уже знаем, как они себя проявляют в отдалённой перспективе. Поэтому сегодня часто появляются сообщения о том, что активность против коронавирусной инфекции нашли у какого-то уже имеющего хождение лекарственного препарата.
Впрочем, сегодня слепой перебор имеющихся лекарств всё-таки скорее исключение из правил.
Разработка лекарств в наши дни процесс рациональный и целенаправленный. Он состоит из нескольких этапов:
Решение о том, от какого заболевания искать лекарство зависит от множества факторов. Иногда вопрос о необходимости медикаментозного вмешательства возникает только при смене лечебной парадигмы. Примером может служить синдром дефицита внимания и гиперактивности. В конце прошлого века он стал одним из любимых диагнозов в педиатрической неврологии. Однако, используемые для его лечения препараты часто оказывались неэффективны или имели ряд нежелательных эффектов. И вот уже несколько десятилетий не утихают споры о том, является ли это особенностью личности или заболеванием, если всё-таки заболевание, то одно или несколько, и следует ли лечить его фармакологически.
Другим примером является лихорадка Эболы. Заболевание очевидно существующее, тяжёлое, с высокой летальностью. При этом надёжного лечения от неё до сих пор не найдено. Но исследовательские группы, занимающиеся разработкой вакцин и химиопрепаратов против этого заболевания часто сталкиваются с недостатком финансирования, из-за чего работа идёт крайне медленно.
Это самая научная часть всей работы. Впрочем, сейчас, в эпоху развития молекулярной биологии и структурной химии, и этот этап превратился в потоковый процесс.
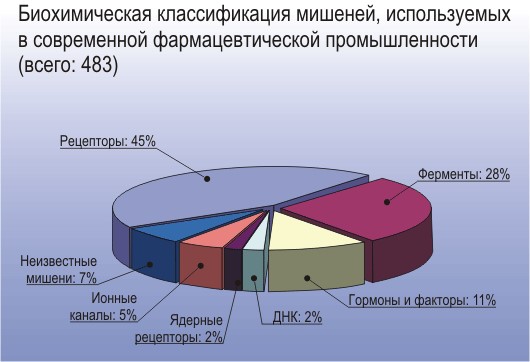
Заболевание обычно связано с тем, что один из белков в клетке, чаще всего клеточный рецептор или фермент, начал работать неправильно. Выявление ответственной за болезнь молекулы и называется поиском биохимической мишени. Именно на них и будут воздействовать лекарственные препараты, усиливая, ослабляя или изменяя работу тех или иных молекул. И даже те воздействия, что казалось бы, действуют не химически, будь то массаж, физиотерапия, охлаждающие или прогревающие средства, тоже оказывают эффект, производя изменения в биохимии клеток. Так что достаточно выяснить, с каким процессом связано недомогание, и как оно регулируется
Увы, на этом этапе много нюансов. В организме все реакции зависят друг от друга, так что нарушение в одном месте влечёт за собой компенсаторные изменения в других. Поэтому даже если виновником проблемы со здоровьем и правда является одно вещество, понять, где берёт начало каскад изменений не всегда просто.
Кроме того, патология может быть связана с изменением активности сразу нескольких молекул. В общем, поиск и проверка молекулярной причины болезни, дело долгое и кропотливое. Чаще всего для того, чтобы выяснить, где кроется причина заболевания, исследователи разными способами последовательно отключают у специально модифицированных лабораторных животных работу различных внутриклеточных систем и регистрируют изменения.
Наконец, мишень найдена. Теперь нужно подобрать пулю, способную поразить эту мишень. И тут опять есть несколько подходов. Лекарство может блокировать мишень, наоборот активировать его, или же поддерживать стандартную активность. Всё это определяется в процессе предварительного компьютерного моделирования. Определяется трёхмерная структура молекулы, на которую будет проводиться воздействие, после чего моделируется его активность после взаимодействия с различными веществами. Затем начинается опыт лабораторного подбора перспективных препаратов.
Сегодня этот этап практически полностью автоматизирован. Из мишени изготавливают тест-систему. Это планшет с огромным количеством ячеек, в каждой из которых присутствует либо особым образом изменённая живая клетка, либо сама мишень, иммобилизированная на полимерной подложке. Сотни роботизированных рук вносят в эти планшеты неразличимые глазом капельки потенциальных лекарств. То, какие вещества вообще могут оказаться подходящими, определяют при помощи обширных библиотек “химического пространства” ‒ этим термином называют потенциальные связи, которые могут образовывать разные конфигурации атомов.
На этом этапе ещё не стоит цели найти подходящее лекарство. Исследователи просто смотрят, какие вообще соединения могут оказывать воздействия на вещество-мишень. Так проверяются миллионы соединений, до тех пор, пока их количество не сократится до нескольких сотен.
Теперь у потенциальных кандидатов в лекарство определяют биохимические и физические показатели. Это необходимо, чтобы выяснить, каким образом лекарство может поступать в организм, и не оказывает ли оно воздействия помимо того, которое необходимо.
Часть этих показателей опять-таки можно определить при помощи компьютерного прогнозирования. Новости о том, что тот или иной анализатор крупных баз данных, их ещё называют big data, научился выявлять какое-то новое свойство моделированных молекул, появляются едва ли не каждую неделю. На этом этапе отсеивается подавляющая часть веществ. Оставшиеся кандидаты, их обычно бывает не больше пары десятков, переходят на следующий этап.
И всё же, увы, компьютеры пока не всесильны. Так что следующим этапом идёт цикл доклинических и клинических испытаний. Различаются они тем, что доклинические исследования проводят на животных, а клинические ‒ на людях.
Цель этого этапа, выяснить, действительно ли выбранные препараты оказывают требуемое воздействие на мишень и в живом организме, а не только в компьютерной и искусственной модели, убедиться в безопасности выбранного вещества, и подобрать подходящую лекарственную форму. Этот этап может оказаться самым длительным во всём процессе разработки лекарства. Практически всегда цикл испытаний занимает годы, а иногда и десятилетия.
Вначале вещества-кандидаты проверяют на нескольких животных моделях. Увы, зверей, биохимия который в точности соответствует человеческой в природе нет, так что приходится провести несколько циклов испытания. Грубую оценку свойств препарата проводят на массовых моделях. Обычно это бывают мыши, крысы, морские свинки и кролики. Дальше в дело вступают более специфичные модели. Хорьки похожи на нас иммунитетом, обезьяны ‒ организацией нервной системы, свиньи ‒ системой метаболизма веществ и кожными реакциями.
Затем наступает время испытания на людях. Этот этап часто оказывается самым тормозящим весь процесс разработки лекарства. Этическая составляющая процесса требует особенно тщательного контроля со стороны проверяющих органов. (Рекомендуем статью: "Лабораторная диагностика COVID-19")
Клинические испытания делятся на три фазы:
И вот мы наконец добрались до последнего этапа. Здесь тоже есть несколько подходов. Если раньше почти всегда лекарства оказывались низкомолекулярными соединениями, последнее время всё чаще для лечения используют белки ‒ ферменты, моноклональные антитела, сигнальные молекулы для клеточных и ядерных рецепторов. Их производство отличается от синтеза лекарств прошлой эпохи.
При создании стандартного низкомолекулярного лекарственного средства, подбирается наиболее экономически выгодный путь его синтеза. Сюда входит поиск сырья, методы извлечения целевого вещества и его модификации. Либо, если в производстве не используются природные «полуфабрикаты», то разрабатывается установка для последовательного проведения всех необходимых реакций.
Для создания биофармацевтических препаратов используют не химические реакторы, а особым образом изменённые живые организмы. Чаще всего бактерий или растения. При помощи своеобразного молекулярного шприца ‒ вектора, в генетический код таких живых фабрик вставляют гены, кодирующие требуемый препарат.

Ну а дальше всё просто. Организм или колония растёт, накапливая требуемый лекарственный препарат в клетках, или выделяет его в окружающую среду. А затем это вещество извлекают, очищают и превращают в лекарственный препарат. Пока что подобные лекарства, нечасто увидишь в аптеке. Они встречаются только в крупных или специализированных лечебных центрах. Однако, белковые лекарства уверенно отвоёвывают своё место под солнцем.
На сегодня это всё, всего вам доброго. Пусть все ваши знания о лекарствах остаются сугубо теоретическими.
С помощью личного кабинета Вы сможете:
Сравнение