
История
Часть товаров из корзины будет перемещена в статус отложенных и не сможет быть оформлена для заказа, если вы продолжите работу в данном регионе
История

История
История
Содержание статьи:
Это первая часть заключительного в 2021 г. вебинара «Биотехнология: контроль качества биотехнологических препаратов», состоявшегося 9 декабря 2021 г. в рамках проекта «Онлайн-лекторий Диаэм». Представитель «Диаэм» Леонид Усович рассказал о применении вестерн-блоттинга в анализе белков.

Вестерн-блоттинг – разновидность блоттинга, объединяющего методы молекулярной биологии, которые предполагают перенос определённых белков или нуклеиновых кислот из раствора (в котором могут содержаться и другие молекулы) на какой-либо носитель для последующего анализа. В одних случаях этому предшествует гель-электрофорез, в других производится непосредственный перенос на мембрану, а затем следует визуализация молекул с помощью различных приемов. Вестерн-блоттинг – это описанный аналитический метод, применяемый для детекции белков с 70-х годов прошлого века. Благодаря своей простоте он приобрел очень широкую популярность для этих целей.
Удобство вестерн-блоттинга состоит в возможности детектировать целевой белок прямо в смеси и анализировать экспрессию, регуляцию в ответ на внешние стимулы и модификации. Существует очень много различных вариаций и техник реализации анализа белков.
Статистика показывает, что в лабораториях мира ежегодно выполняется до 5000000 анализов с применением этого метода.
Идентификация специфичных белков в образце с помощью вестерн-блоттинга (вестерн-блота, белкового иммуноблота) требует первоначального выделения белков из образца, а далее включает три стадии:
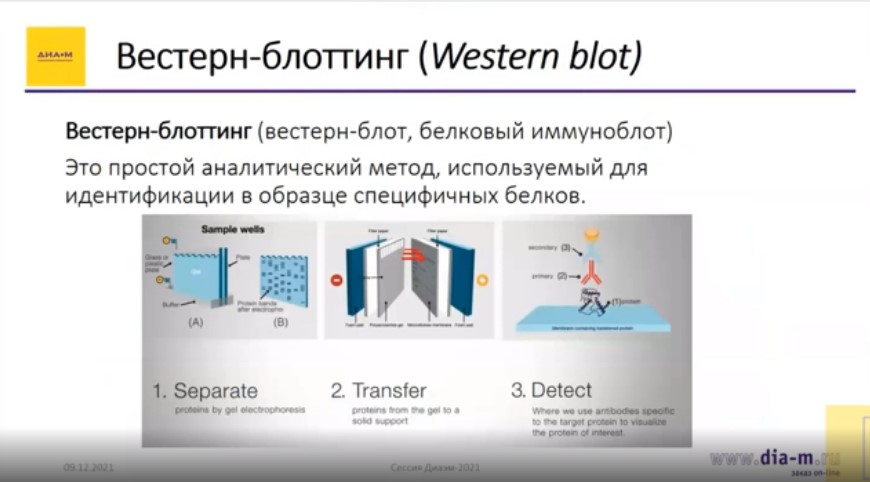
После выделения белков из образца (1) электрофорез смеси белков проводится в полиакриламидном геле (2), затем разделенные белки переносятся (переводятся) на специальную PVDF мембрану, обрабатываются блокирующим агентом (BSA), чтобы остановить реакцию, и антителами, специфичными к искомому белку, потом идет серия промывочных работ, и далее белки детектируются, для чего используются первичные/вторичные антитела, меченные хромогенами или флуорофорами.

На этапе электрофореза используются камеры для электрофореза и готовые гели, затем на стадии переноса – различные системы переноса, например, системы мокрого переноса, для гибридизации – различные устройства, в том числе автоматизированный протокол переноса с помощью системы Thermo iBind, а далее для детекции – гель- и хемидокументирующие системы.
Наверняка многие пользователи сталкивались с электрофорезом белков. Он чаще всего имеет вертикальную реализацию в противовес горизонтальному электрофорезу ДНК, который гораздо проще, потому что требует использования одного геля. А электрофорез белков чаще всего задействует многослойный гель, который зачастую приходится делать самостоятельно. Это достаточно трудоемкий и долгий процесс. Тем не менее это один из самых популярных и удобных методов, чтобы проанализировать и найти конкретные молекулы с различными молекулярными массами в образцах.
Количественное определение белков, определение различных примесей и молекулярной массы – таковы функциональные возможности метода. Это именно аналитический метод; он используется главным образом в разработке и чуть меньше – на производстве.

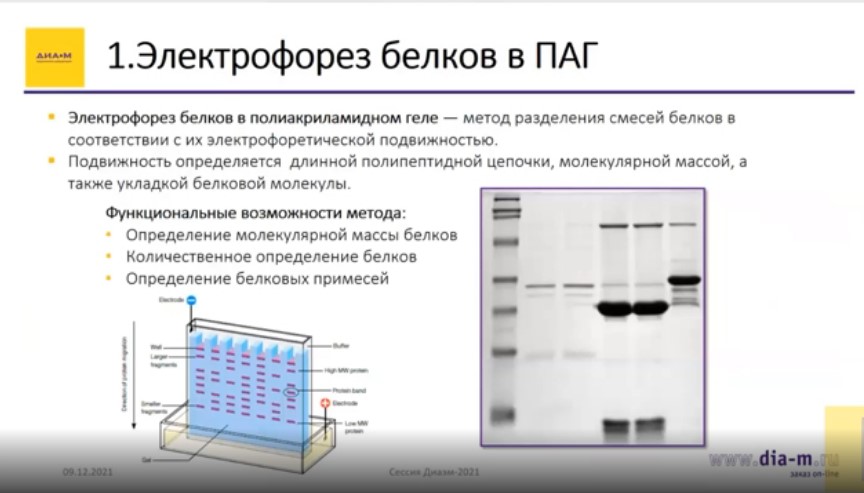
Электрофорез белков в полиакриламидном геле – метод разделения смесей белков в соответствии с их электрофоретической подвижностью. Подвижность определяется длиной полипептидной цепочки, молекулярной массой, а также укладкой белковой молекулы. Функциональные возможности метода позволяют определять молекулярную массу белков, проводить количественное определение белков и определять белковые примеси.
На данный момент есть два пути: приготовить гель самостоятельно или использовать готовый.(Рис. 1)
Готовые гели для многих пользователей стали настоящим открытием на рынке, настолько это предложение оказалось удобным.
Самостоятельное приготовление геля связано в первую очередь с закупкой необходимых реактивов и вспомогательных приборов – отдельных систем для заливки гелей, их хранением, приготовлением специализированных буферных растворов из этих реактивов, а потом с заливкой самого многослойного геля.
Это очень трудоемкий долгий процесс, который без соответствующей сноровки и навыков непросто реализовать быстро и аккуратно, к тому же в ряде случаев приходится использовать опасные для здоровья реагенты. Единственное преимущество ручной заливки – как правило, это дешевле.
Другое дело – использовать готовые гели. Компания Thermo FS и ее подразделение InVitrogen выпустили готовые гели сразу в пластиковой подложке, что делает их использование максимально удобным, а главное – дает, пусть и при более высокой стоимости, колоссальную экономию времени, потому что они упакованы и сразу готовы к использованию, сразу готовы к загрузке образца объемом до 60 мкл, подразумевают возможность работы с разными реактивами (трис-глицин, трицин, трис-ацетат, бис-трис).
Существует огромный выбор гелей для различных целей, они в основном имеют нейтральный pH, и это упрощает работу.
Классические камеры(например, для миди-формата – на 1-2 миди-геля 8х13 см), с которыми наверняка все работали – устройства крайне неудобные, имеющие огромное количество сложных элементов и вообще сложную конструкцию. Часто гребенку невозможно нормально зафиксировать, лунки с одной стороны могут получиться одной глубины, с другой стороны камеры – другой глубины, в итоге образец может просто не поместиться в них. Камера может встать криво – а значит, старт произойдет с разной высоты. Это тоже неудобно и не лучшим образом влияет на результаты.

Из расположенной внизу ванночки, в которую заливается буфер, очень легко пролить этот раствор, особенно если процесс уже запущен. Сложно контролировать и детектировать, на каком этапе «бегут» белки, потому что две прозрачные камеры расположены друг напротив друга с разных сторон. Чтобы рассмотреть ход процесса, камеру необходимо повернуть, а при повороте раствор легко может пролиться.
Кроме того, в камерах используются стеклянные компоненты, и крепление зажимами можно легко перетянуть – тогда стекло треснет. Ситуацию осложняет то, что в камере для электрофореза используется общий объем буфера для двух отделений камеры. То есть прибор предназначен для двух гелей, в него заливается общий буфер. Можно запустить два геля одновременно, но если есть необходимость запускать только один гель, то объем буфера используется все равно вдвое больший – в расчете на две камеры. В этом нет ни особой экономии. ни удобства.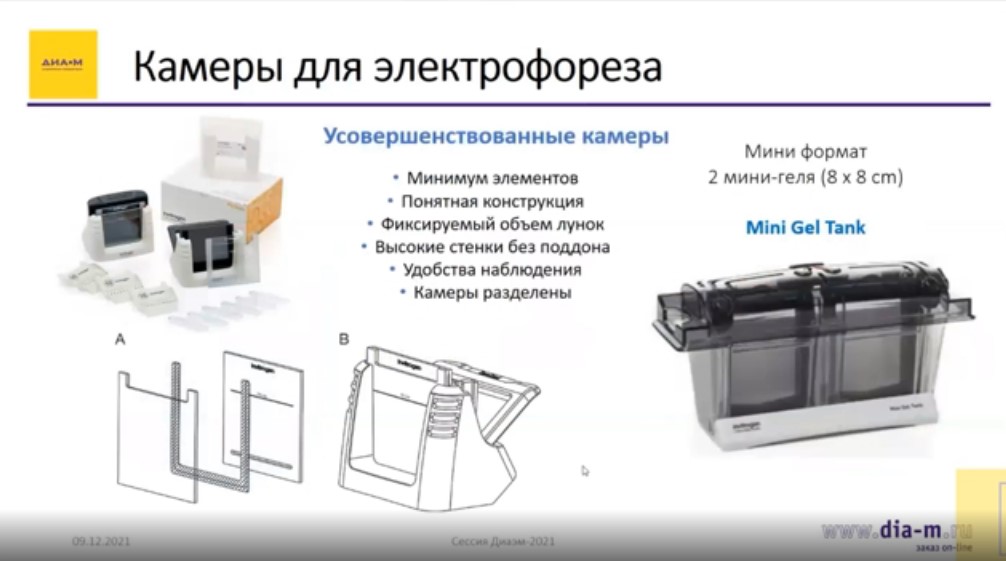
Более усовершенствованные камеры, если говорить о классическом методе самостоятельного приготовления гелей, содержат минимум (всего 4) элементов и более понятную конструкцию и подразумевают использование специализированных заливочных столиков, также конструктивно простых. В этих устройствах есть стекло, подложка и хорошо видно, куда заливается гель, зажим простой конструкции, лунки фиксируются в одном положении, всегда имеют одинаковый объем, получаются идеально ровными.
ThermoFS представляет камеру для электрофореза Mini Gel Tank. Здесь используются гели чуть меньшего формата – 8 на 8 см, но тем не менее лунок может быть столько же. Это зависит от гребенки.
Удобство устройства состоит в предельной простоте конструкции: никакой сборки не требуется, камеры разделены: буфер заливается в одну часть камеры, если нужно использовать один гель. Можно легко запустить процесс, экономя при этом буферный раствор. И очень легко наблюдать за ходом процесса: на белом фоне все смотрится очень контрастно и очень удобно.
У этого процесса есть свои особенности. Когда прошел электрофорез, нужно достать гель, после чего все данные, которые там есть, перенести на мембрану.
Для этого используется так называемая техника мокрого переноса. Это одна из разновидностей, представляющая собой довольно длительный процесс, проходящий примерно за час.
Для этого собирается своеобразный «сэндвич»: внизу пластиковое основание, далее губка, фильтровальная бумага, гель, мембраны, снова фильтровальная бумага и губка. Вся эта конструкция закрывается также пластиковым корпусом, который вставляется внутрь камеры и далее идет процесс.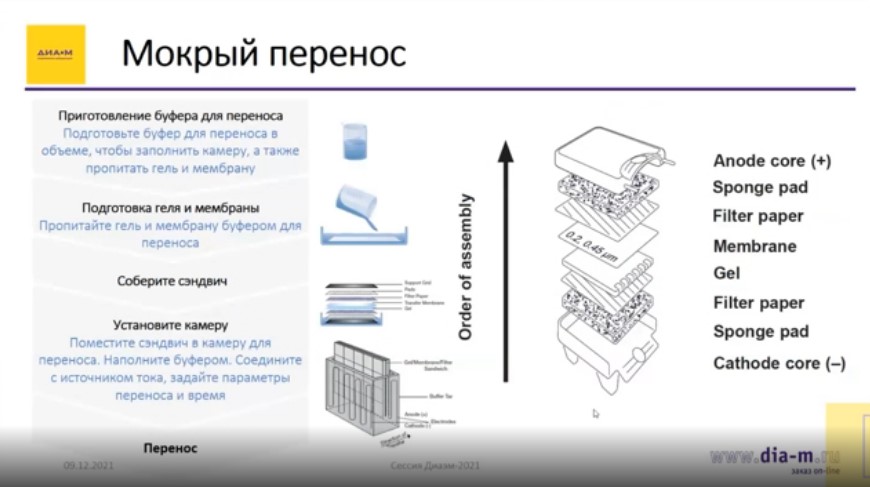
Использование модуля Mini Blot Module, устанавливаемого в емкость под названием Invitrogen Mini Gel Tank, требует меньшего использования метанол-содержащего буфера для переноса: и метанола на приготовление буфера потребуется меньшее количество, и сам объем буфера для процесса уже не столь велик. За счет меньшего свободного объема для переноса достаточно 30-60 минут.
Необходимо вначале подготовить буфер для переноса, заполнить им камеру, пропитать гель и мембрану этим буфером, после чего собрать сэндвич, установить камеру и запустить перенос.
После того, как разделенные электрофорезом белки перенесены на мембрану, необходимо окрасить блот.
Классическим методом окрашивания является использование качалки: мембрана помещается в ванночку, заливается реагентами, первичными антителами, потом три раза промывается, далее инкубируется со вторичными антителами, после чего промывается снова. Весь классический протокол занимает до 4 часов. При этом оператор не может отойти от процесса, не может покинуть рабочее место. Необходимо постоянное присутствие человека и его вмешательство в процесс.
Это отнимает много времени и трудозатрат.
На слайде: блокирование по классическому протоколу требует 20-60 минут, инкубация с первичными антителами – 1-24 часа, трехкратная промывка – трижды по 5 минут, далее следует 1-часовая инкубация со вторичными антителами и еще одна пятикратная промывка (5 раз по три минуты). Мембрана при этом помещается в ванночку и заливается реагентами, которые проникают в мембрану диффузно. Так что классический протокол при своей продолжительности в среднем до 4 часов содержит много стадий, на которых пользователь может допустить ошибку.
Более усовершенствованные методы подразумевают использование системы автоматического окрашивания iBind от ThermoFS.
Для сравнения: вручную это делать трудоемко, а система iBind помогает в автоматическом режиме проводить все этапы окрашивания: обработку первичными антителами, промывку, обработку вторичными антителами и заключительную промывку. Это довольно простое устройство в пластиковом корпусе, к нему в комплекте прилагаются специализированные мембраны и соответствующие буферы.(Рис.2)
Преимущества системы автоматического окрашивания iBind в том, что при автоматизированном окрашивании растворы антител мигрируют за счет давления и материала подложки без применения внешнего источника энергии. Применение устройства, совместимого с различными системами детекции, не только позволяет экономить до 80% антител, но и усиливает специфичность и чувствительность блоттинга.
На слайде: сначала пользователь наливает воду, затем буфер, промывает мембрану.
Далее пользователь добавляет первичные и вторичные антитела, из набора достает карту, помещает в упоры, чтобы она ровно лежала, наливает 5 мл буфера, чтобы ее промочить, укладывает мембрану, наливает буфер.
Пузырьки удаляются с помощью специализированного роллера.(Рис. 3-4)
Все должно упираться в специальные упоры; система закрывается, наливаются первичные антитела, промывочный буфер, вторичные антитела и еще один промывочный буфер – всего 6 мл.
Далее устройство нужно закрыть и можно оставить его на всю ночь, а потом прийти, промыть в воде – и все готово. Все это гораздо проще, эффективнее, быстрее; кроме того система позволяет экономить до 80% антител.
Это заключительный этап вестерн-блоттинга.
Важно понять, прошел ли электрофорез (визуализировать его результаты), перенесены ли белки на мембрану (нужно оценить результат этого переноса) и есть ли искомый белок на мембране (и каков собственно результат иммуноблоттинга), то есть правильно ли проделана работа. Это и является подтверждением.
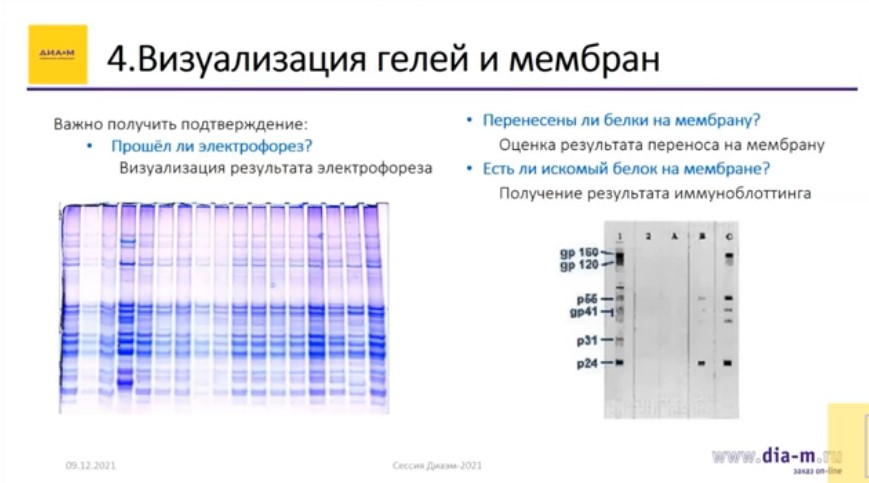
Визуализация проводится с помощью специализированных гель- и хемидокументирующих систем.
Они подходят для анализа гелей электрофореза, мембран иммуноблоттинга, а также для исследования растений, животных, для подсчета колоний микроорганизмов in vivo и других целей.

Методы, которые доступны – колориметрия, УФ-флуоресценция, мультиплексная флуоресценция, хемилюминесценция и биолюминесценция.
На сайте Диаэм представлен широкий выбор различных комплектаций и дополнительных опций: гели, камеры – классические и продвинутые; помимо продукции ThermoFS есть еще системы Bio-Rad. Специалисты Диаэм готовы проконсультировать по любому вопросу, связанному с выбором продукции для исследовательских целей.
Ссылки на остальные части вебинара:
Новость о вебинаре «Биотехнология: одноразовые и классические технологии в масштабировании и производстве»С помощью личного кабинета Вы сможете:
Сравнение