
История
Часть товаров из корзины будет перемещена в статус отложенных и не сможет быть оформлена для заказа, если вы продолжите работу в данном регионе
История

История
История
В каждую эпоху есть технология, определяющая взгляд людей на окружающую реальность. В шестидесятых это были космические полёты. Затем такой технологией была атомная энергетика. Ей на смену пришли компьютерные технологии. Сегодня сферой науки, определяющей мышление поколений, можно назвать биотехнологии.
Дело тут не только в пандемиях последних лет. Раньше страхи людей сосредотачивались вокруг генетически модифицированных продуктов. Теперь мы учим наши машины думать тем же способом, которым мыслим сами, и придаём роботам сходство с живыми существами. Всё это стало возможно благодаря тому, что люди заглянули за кулисы тайны жизни.
С развитием молекулярной биологии нам всё яснее становятся сложнейшие механизмы, обеспечивающие жизнь. И в основе всего этого многообразия невероятно сложных реакций лежит ДНК. Неупорядоченный кристалл, как называл его великий физик Эрвин Шредингер ‒ создатель знаменитого одновременно живого и мёртвого кота.
Подобно этому коту, дезоксирибонуклеиновая кислота находится на границе живой и мёртвой природы. Самые примитивные из организмов, которым многие учёные до сих пор отказывают в праве считаться живыми, состоят почти исключительно из нуклеиновой кислоты. Всего несколько белков защищают их от внешнего мира до той поры, пока эти высокоспециализированные паразиты не попадут в живую клетку, где их генетический материал сможет переступить границу, отделяющую вещество от существа.
 Всё это теперь известно нам, потому что мы уже знаем, как работает передача генетической информации в живых организмах. ДНК, словно сложный текст описывает все содержащиеся в нашем организме белки. Научившись читать этот текст, мы смогли понять, что и как работает внутри наших клеток, где стоит ожидать нарушений, и как можно их скомпенсировать, а то и вовсе предотвратить.
Всё это теперь известно нам, потому что мы уже знаем, как работает передача генетической информации в живых организмах. ДНК, словно сложный текст описывает все содержащиеся в нашем организме белки. Научившись читать этот текст, мы смогли понять, что и как работает внутри наших клеток, где стоит ожидать нарушений, и как можно их скомпенсировать, а то и вовсе предотвратить.
В 2003 году был завершён фундаментальный проект Геном человека. Это огромная работа множества научных групп по всему миру. В рамках этого проекта был полностью прочитан и аннотирован, то есть снабжён комментариями относительно функций, исполняемых различными участками, геном человека. Помимо огромной теоретической и практической пользы, этот проект поспособствовал значительному развитию технологий чтения генетической информации.
Процесс чтения последовательности нуклеиновых кислот называется секвенированием, от латинского слова sequentum, что значит последовательность. Нуклеиновая кислота ‒ это невероятно длинный по меркам клетки полимер, состоящий из мономеров ‒ нуклеотидов. Всего нуклеотидов бывает пять видов. Аденин, гуанин, цитозин и тимин входят в состав ДНК, а урацил заменяет тимин в РНК. То, в какой последовательности будут выстроены эти мономеры в нити нуклеиновой кислоты и определяет, какой белок кодирует данный ген.
Конечно, далеко не все участки нуклеиновых кислот кодируют какие-то белки. И работа генетической машины часто корректируется эпигенетическими, то есть не наследуемыми способами. Но в любом случае именно порядок, в котором расположены нуклеотиды и определяет свойства нуклеиновой кислоты. Этот порядок и определяют при помощи секвенирования.
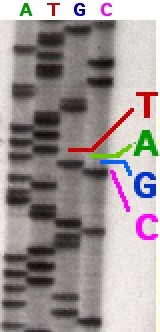 Есть несколько различных методов секвенирования. Но наиболее известный и до сих пор не потерявший своего значения ‒ это метод секвенирования по Сенгеру. На самом деле, у этого метода есть два вида. Более ранний и трудоёмкий ‒ плюс-минус секвенирование. И более новый, использующийся и по сей день ‒ метод терминаторов.
Есть несколько различных методов секвенирования. Но наиболее известный и до сих пор не потерявший своего значения ‒ это метод секвенирования по Сенгеру. На самом деле, у этого метода есть два вида. Более ранний и трудоёмкий ‒ плюс-минус секвенирование. И более новый, использующийся и по сей день ‒ метод терминаторов.
В обоих случаях требуется помощь ДНК-полимеразы, фермента, который обеспечивает синтез новой цепи нуклеиновой кислоты внутри клетки. Благодаря ему на основании имеющегося образца ДНК, который и требуется прочитать, синтезируется новая молекула. Однако часть нуклеотидов ‒ мономеров, из которых строится цепь читаемой нуклеиновой кислоты, изменена.
В случае плюс-минус секвенирования происходит сразу восемь реакций в восьми пробирках причём каждая пара пробирок отвечает за выявление позиций одного из четырёх нуклеотидов. Одна пробирка из пары содержит нуклеотид в таком виде, что синтез цепи после него обрывается. В другой же пробирке реакционная смесь подобрана таким образом, чтобы обрываться до то7о, как должен быть встроен определённый нуклеотид. То есть, в результате в каждой из пробирок образуется смесь кусков нуклеиновой кислоты разной длины. И в зависимости от того, из какой пробирки эта смесь получена, оканчиваться все эти фрагменты будут либо одним из четырёх нуклеотидов, либо на позиции, непосредственно перед ним.
Дальше эту смесь можно просто разделить при помощи электрофореза. Длина пробега фрагмента, а она зависит от его размера, будет соотноситься с положением “буквы” в тексте генного материала.
Метод терминаторов чуть проще. Фактически, он составляет половину плюс-минус метода. В нём оставлен только “плюс”. То есть в каждой уже только из четырёх пробирок содержатся все нуклеотиды, но один есть ещё и в модифицированном виде, после которого цепь не будет дальше расти. Точно так же, как и в прошлом методе, в каждой из четырёх пробирок образуется смесь продуктов реакции, длина которых указывает на положение того или иного нуклеотида в последовательности гена.
Надо сказать, что сегодня метод терминаторов развился ещё дальше. Теперь всю реакцию можно проводить в одной пробирке. Просто конечные нуклеотиды теперь помечены светящимися в свете лазера молекулами, так что в единой реакционной смеси можно выяснить, каким именно нуклеотидом заканчивается тот или иной фрагмент.
Именно эта методика лежит в основе работы автоматических секвенаторов. В процессе их работы продукты реакции в реальном времени начинают двигаться под воздействием градиента электрического поля по специальным капиллярам, где и считывается их последовательность.
 Стоит сказать, что хотя секвенирование по Сенгеру сейчас самый известный метод, на заре эры секвенирования были и другие. Они отличались от ныне используемого подхода тем, что в отличие от метода по Сенгеру не наращивали цепь по имеющемуся образцу, а наоборот, последовательно разрушали этот образец, регистрируя каждый отщеплённый нуклеотид. За это они получили название методов деградации, то есть уменьшения нуклеотидной цепи. Однако это были сугубо химические методы. Потому в эпоху биотехнологических методов они не смогли удержать своих позиций. Сегодня правят бал методы, подражающие процессам в живых клетках, использующие ферменты и прочие молекулы, выделенные из живых организмов.
Стоит сказать, что хотя секвенирование по Сенгеру сейчас самый известный метод, на заре эры секвенирования были и другие. Они отличались от ныне используемого подхода тем, что в отличие от метода по Сенгеру не наращивали цепь по имеющемуся образцу, а наоборот, последовательно разрушали этот образец, регистрируя каждый отщеплённый нуклеотид. За это они получили название методов деградации, то есть уменьшения нуклеотидной цепи. Однако это были сугубо химические методы. Потому в эпоху биотехнологических методов они не смогли удержать своих позиций. Сегодня правят бал методы, подражающие процессам в живых клетках, использующие ферменты и прочие молекулы, выделенные из живых организмов.
Секвенирование по Сенгеру точное, надёжное, может справиться с достаточно большими участками генома. Но есть у него и недостаток. Оно достаточно медленное, и единовременно может читать только один участок нуклеиновой кислоты. Сегодня же, когда существует масса уже прочитанных референсных геномов, на которые можно ориентироваться, исправляя ошибки прочтения, скорость и многозадачность становятся важным преимуществом для методики. Поэтому всё больше используется секвенирование нового поколения, или next-generation sequencing (NGS).
В большинстве случаев технологически методики секвенирования нового поколения похожи на классический метод секвенирования по Сенгеру. Разве что обычно у них есть какое-либо усовершенствование, позволяющее определять какой нуклеотид присоединился к цепи прямо в процессе реакции. Обычно для этого используют либо какие-то реакции с заранее пришитыми нуклеотидам люминофоры, которые, возможно, потом удаляются для продолжения наращивания цепи, либо в реакционной смеси определяются продукты реакции, характерные для присоединения конкретного нуклеотида.
 Что значительно отличает секвенирование нового поколения от классического, так это подход к получению данных. Если раньше основным методом было достаточно точное прочтение длинных отрезков нуклеотидной цепи, то теперь бал правят статистические методы.
Что значительно отличает секвенирование нового поколения от классического, так это подход к получению данных. Если раньше основным методом было достаточно точное прочтение длинных отрезков нуклеотидной цепи, то теперь бал правят статистические методы.
Исследуемая ДНК предварительно фрагментируется, образуя множество более или менее коротких отрезков. Затем эти отрезки многократно размножаются и прочитываются много раз. Полученные данные легко сравнить с имеющимся референсным геномом и выявить отличающиеся от него позиции.
Конечно, подобный подход требует специального программного обеспечения, способного работать с подобными множественными прочитанными фрагментами. Для человека разобраться в том ворохе мелких отрезков нуклеиновой кислоты, разной длины, происходящих из разных локаций, было бы крайне затруднительно. Программы же очень быстро выравнивают, то есть находят соответствия, между полученными прочтениями и уже имеющимися в базах данных последовательностями.
Скорость и широта прочтений в секвенировании нового поколения позволили проводить те исследования, что было бы очень непросто осуществить при помощи классического метода. Наверное, самое частое применение новых методов, которые приходится видеть в самых передовых научных статьях ‒ это определение функциональной активности генома.
Суть этого подхода в следующем. Полимерные нуклеиновые кислоты ‒ это не только ДНК, хранящая всю требуемую организму информацию, но и РНК ‒ рабочие лошадки, превращающие скрытую в геноме информацию в белки, обеспечивающие работу и структуру клетки. Выявление последовательностей присутствующих в клетке матричных РНК даёт представление о том, какие именно гены активны в данный момент.
И всё же, у секвенирования нового поколения есть свои слабые стороны. В первую очередь они связаны именно с фрагментацией и способностью читать только небольшие отрезки полинуклеотидов. Это становится проблемой, когда необходимо прочитать геном, для которого нет референсной последовательности. Конечно, статистические методы могут справиться и с этим вызовом. Но в большинстве случаев подобные задачи уже требуют подключения человека, дополнительных методов секвенирования и длительного времени на обработку полученных данных.
Решить подобную проблему могут методы одномолекулярного секвенирования или SMRT-секвенирование (single molecule real time sequencing). Формально они тоже относятся к секвенированию нового поколения, но их технологии значительно отличаются от прочих вариантов.
 Особенности одномолекулярного секвенирования
Особенности одномолекулярного секвенированияНазвание этого семейства методов происходит от того, что в них отсутствует этап полимеразной цепной реакции. То есть, единственная молекула нуклеиновой кислоты подвергается анализу при помощи устройств, имитирующих процессы, происходящие в живой клетке.
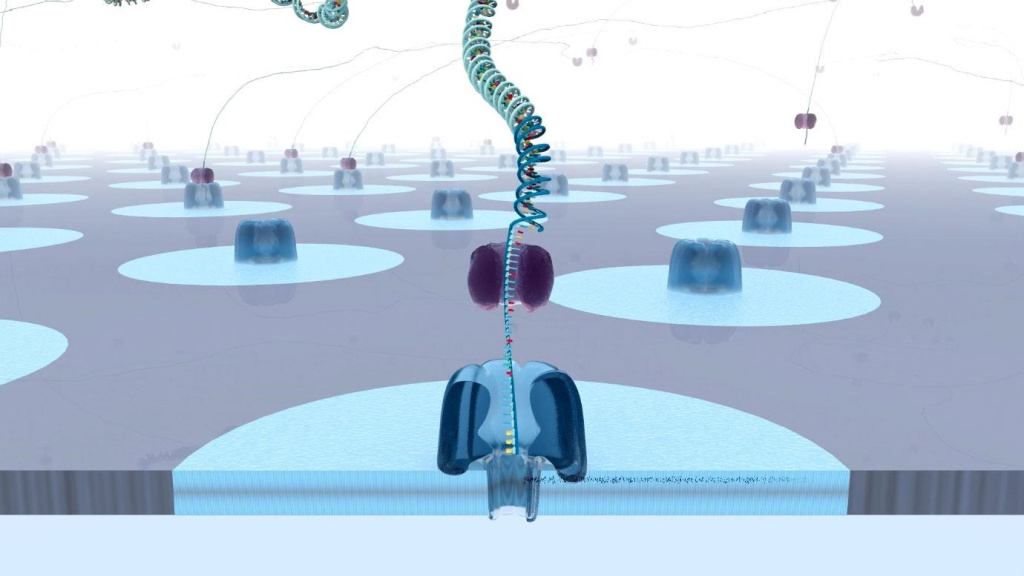
Первый из этих методов ‒ нановоровое секвенирование. Суть его в том, что анализируемая молекула помещается в крошечный контейнер, разделённый пополам мембраной, имитирующей клеточную. В этой мембране даже есть единственная белковая пора, совсем как это бывает у живых клеток.
Впрочем, на этом сходство с живой структурой оканчивается. Между стенками контейнера создаётся разность потенциалов. Это служит сразу двум целям. Во-первых, приходит в движение заряженная молекула нуклеиновой кислоты. Под действием магнитного поля, она движется сначала к мембране, а затем сквозь неё, через пору. Второй задачей электрического потенциала становится создание ионного тока. Помимо нуклеиновой кислоты через ту же пору движется поток ионов, и его сила количественно зависит от напряжённости электрического поля.
Когдануклеиновая кислота проходит через пору, её просвет сужается, и сила ионного тока падает. Причём падает в разной степени в зависимости от того, какой именно нуклеотид в этот момент пересекает мембрану. Постоянное измерение силы ионного тока позволяет выяснить последовательность проходящих сквозь мембрану нуклеотидов.
Нановоровое секвенирование сейчас можно считается не передовой технологией в деле чтения генетической информации. Оно требует минимальной пробоподготовки, позволяет читать довольно длинные последовательности, превосходящие те, что доступны секвенированию по Сенгеру в сотни раз. Ну и, наконец, технологическое оснащение, необходимое для нанопорового секвенирования может в прямом смысле поместиться в карман. В отличие от довольно громоздких секвенаторов, требуемых для прочих методов, здесь всё оборудование будет размером чуть больше флешки. Конечно, как и флешку, его придётся подключить к компьютеру. Но всё равно, размер его по-настоящему удивляет тех, кто привык к современному лабораторному оборудованию. Ходят слухи даже о скором появлении секвенатора, который сможет работать от обычного смартфона.
 Существуют и иные методы одномолекулярного секвенирования. Среди них использование высокропроизводительных ферментов, применение эмульсионных микрореакций, создание иммобилизированных чипов с закреплёнными на них адаптерами ДНК. Все эти методы появились в последние десятилетия, и прогресс технологии выяснения последовательностей генетического материала не собирается останавливаться.
Существуют и иные методы одномолекулярного секвенирования. Среди них использование высокропроизводительных ферментов, применение эмульсионных микрореакций, создание иммобилизированных чипов с закреплёнными на них адаптерами ДНК. Все эти методы появились в последние десятилетия, и прогресс технологии выяснения последовательностей генетического материала не собирается останавливаться.
Уже стали возможны многие исследования, невозможные с применением традиционных методов. В первую очередь это исследование различных метагеномных изменений нуклеиновых кислот. То есть химических изменений самой молекулы ДНК, которое в значительной мере влияет на её работу в конкретном организме, или даже в той или иной ткани. При этом метагеномные изменения не передаются по наследству, и, судя по всему, вызваны условиями среды, в которой оказывается организм.
Другой важной областью современной геномики является изучение транскриптома. То есть тех посредников, которые переносят генетическую информацию из ядра клетки в её рабочее пространство. Именно благодаря таким исследованиям стало известно, что большинство матричных РНК отличаются от генов, копией которых они являются. Перед тем, как послужить матрицей для синтеза белка, информационные молекулы созревают.
Наиболее это выражено у головоногих моллюсков. Фактически, у них один и тот же участок ДНК может содержать несколько генов, в зависимости от того, как именно будет “созревать” синтезированная на нём РНК.
Сегодня мы живём в эпоху стремительно развивающихся биотехнологий. Основой для этого прогресса целой области промышленности и науки стало появление всего нескольких исследовательских методов, продвинувших наше понимание молекулярных механизмов жизни. И, пожалуй, самым важным из этих методов, или даже семейства методов стало секвенирование миологических полимеров, и в первую очередь, нуклеиновых кислот. Несмотря на то, что первые методы секвенирования появились ещё в середине прошлого века, развитие этой области знаний не останавливается до сих пор. А значит впереди нас ещё ждут многие открытия, которые, быть может, в корне изменят наше представление о сущности жизни. Ведь наука ‒ это вечный путь, лишь ускоряющийся с появлением более удобного снаряжения.
С помощью личного кабинета Вы сможете:
Сравнение